|
Last update
2008-06-10 19:43
 Outline Outline
当研究室は、細胞内で起こる重要なイベントに関与するタンパク質群を対象に、それらの立体構造で決定し、生体高分子間の多元的な相互作用に基づく機能発現機構を構造科学的に解析し、分子認識や制御機構といった細胞で起こる基本的なプロセスを物理化学的な手法を用いて構造生物学的見地から明らかにすることを目的にしている。対象としているタンパク質は、主にヒト、植物、酵母由来のタンパク質で、情報伝達に関与するタンパク質やDNAの転写・複製・修復・組換に関与するタンパク質であり、それらは疾患に関与している物も少なくない。主な研究手法はX線や中性子線を用いた結晶構造解析法、溶液散乱法および核磁気共鳴法(NMR)であり、これらの手法を相補的に用いる。結晶構造解析法で得られる原子レベルの詳細な高次構造や分子間の多元的相互作用とともに、溶液散乱法を用いてリガンド結合に伴う高次構造変化の動的解析や非天然状態の動的挙動を解析する。また、NMRから得られる構造情報を組み合わせて、生体超分子複合体の構造と機能との関連をより詳細に明らかにすることを目指している。
X-ray or neutron diffraction (scattering) analysis of biologically important
systems such as DNA transcription / recombination / repair / replication
/ translation and intracellular signal transduction is of particular
importance to elucidate the structure-function relationship of the biological
systems in living cells. Our ultimate goal is to understand the protein-protein,
protein-nucleic acid or protein-lipid interactions from the high resolution
crystal structure analysis and the time-resolved solution scattering
analysis, and to establish general principles for architectures of biological
supramolecular complexes to describe the physical chemistry of these
cellular functions.
 Macromolecular
Structures Macromolecular
Structures
 |
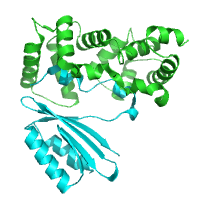 |
 AtCBL2-AtCIPK14 complex AtCBL2-AtCIPK14 complex
Akahoshi et al. (2008)
PDB:
2ZFD
|
 |
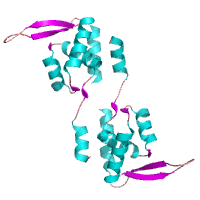 |
 Circadian clock modifiier, PEX Circadian clock modifiier, PEX
Arita et al. (2006)
PDB:
2E1N
|
 |
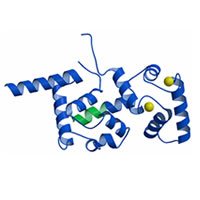 |
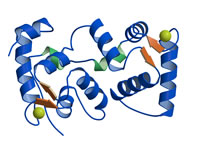
 Calcineulin
Homologous Protein 1 (CHP1) Calcineulin
Homologous Protein 1 (CHP1)
Naoe et al. (2005)
PDB:
2CT9
CHP1はカルシニューリン B サブユニットと高い相同性を示すEF-hand カルシウム結合タンパク質である。
CHP1 は複数のタンパク質と相互作用しその機能を調節する細胞内多機能タンパク質であることが知られている。本研究では X 線結晶構造解析によりその立体構造を決定しCHP1
の標的認識に関する知見を得た。 |
 |
 |
 Famiy
31 carbohydrate binding module (CBM31) Famiy
31 carbohydrate binding module (CBM31)
PDB: 2COV
糖質関連酵素は糖鎖結合モジュール(CBM)をもつものが多い。CBMは高い特異性で糖鎖を認識し、酵素の触媒活性を高める。CBMその機能から43のファミリーに分類されている。
本研究では、初めてファミリー31のCBMの立体構造を超高分解能で明らかにした。 |
 |
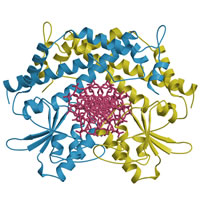 |
 Type
II restriction endonuclease EcoO109I Type
II restriction endonuclease EcoO109I
PDB: 1WTD and 1WTE
II型制限酵素は高い基質特異性をもち、特定のDNA配列を認識し切断するエンドヌクレアーゼである。
本研究では制限酵素EcoO109Iの立体構造を酵素単体およびDNA複合体での結晶構造解析に成功し、DNA認識に伴う構造変化を明らかにした。また、活性残基、反応機構の詳細を明らかにした。 |
 |
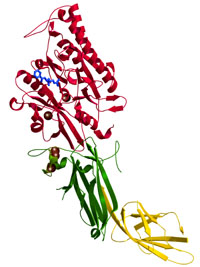 |
 Peptidylarginine
deiminase 4 (PAD4) Peptidylarginine
deiminase 4 (PAD4)
Arita
et al., Nature Struct. Mol. Biol. (2004)
PDB: 1WD8, 1WD9, and 1WDA
ペプチジルアルギニンデイミナーゼ4(PAD4)はカルシウムイオン依存的にタンパク質中のアルギニン残基をシトルリン残基に変換するタンパク質修飾酵素である。ヒトでは5種類のアイソフォームが存在するが、PAD4は唯一核内に存在し、ヒストンのアルギニン残基をシトルリンに変換する。また、最近のSNPSの研究からPAD4遺伝子と関節性リウマチとの関連が注目されている。
本研究では、PAD4単独、PAD4-Ca2+、PAD4-Ca2+-基質複合体の3種の構造解析により、Ca2+による構造変化と活性部位の形成メカニズム、および基質認識機構を明らかにした。 |
 |
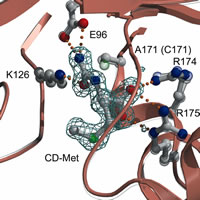 |
 DCase
mutant complex with substrates DCase
mutant complex with substrates
PDB: 1UF4, 1UF5, 1UF7, and 1UF8
N-カルバミル-アミノ酸をD体特異的に脱カルバミル化し、対応するD-アミノ酸を合成する酵素。βラクタム系抗生物質の合成に利用されており、産業的に有用な酵素である。
活性残基であるシステインをアラニンに変換した変異体を作成し、基質複合体の結晶構造を明らかにした。これによって、DCaseの基質認識と反応メカニズムが明らかとなった。 |
 |
 |
 CBL2
from Alabtopsis thaliana CBL2
from Alabtopsis thaliana
Nagae et al., J. Biol. Chem. (2003)
PDB:
1UHN
植物は外界からの刺激に対して、様々なストレス応答を示す。CBL2はFEハンドモチーフを持つカルシウム結合タンパク質であり、光によってその発現が制御されている。CBL2はタンパク質リン酸化酵素CIPK14と結合することで、CIPK14を活性化することが知られている。CBL2の三次元構造からCBL2とCIPK14との相互作用に関する知見が得られた。 |
 |
 |
 Sf11-RNase
from Nicotiana alata Sf11-RNase
from Nicotiana alata
Ida et al., J. Mol. Biol. (2001)
PDB:
1IOO
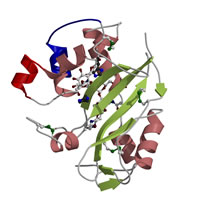
高等植物の多くは、自己の花粉を拒絶して自家受粉を抑制する機構を有する(自家不和合)。タバコ雌しべのS遺伝子産物であるS糖タンパク質(Sf11-RNase)の3次元構造を決定し、花粉との自己・非自己の認識に関する知見を得た。 |
 |
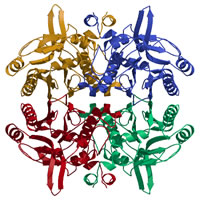 |
 N-カルバミル-D-アミノ酸アミドヒドロラーゼ(DCase) N-カルバミル-D-アミノ酸アミドヒドロラーゼ(DCase)
Nakai et al., Structure (2000)
PDB:
1ERZ
N-カルバミル-アミノ酸をD体特異的に脱カルバミル化し、対応するD-アミノ酸を合成する酵素。βラクタム系抗生物質の合成に利用されており、産業的に有用な酵素である。
結晶構造解析によって、DCaseの三次元構造が初めて明らかとなり、同じ酵素ファミリーに共通の反応機構を提唱した。 |
< 各研究室へのリンク | 生体超分子ホーム | 横浜市立大学ホーム >


|