構造生物学研究室 有田グループの研究成果を掲載
2019.07.12
- TOPICS
- 研究
- 学生の活躍
DNA維持メチル化酵素の複製サイトへの呼び込みの仕組みの一端を解明 (構造生物学研究室 有田グループ)
発表者:治面地 智宏1 (2018年度卒), 松村 るみゑ1 (特任助手), 郡 聡実1 (博士後期1年), 有田 恭平
⇒Research map
⇒Research map
研究分野:構造生物学
キーワード: DNAメチル化、DNA複製、エピジェネティクス、がん、X線結晶構造解析
1 構造生物学研究室 有田グループ
研究成果のポイント
- 複製因子PCNAとDNAメチル化酵素DNMT1の複合体の結晶構造を2.3 Å分解能で決定
- DNMT1のPIP motif (PCNA interacting peptide) は、分子内で水素結合を形成することにより、PCNAとの相互作用を安定化する
- DNA複製とDNA維持メチル化の生命現象の機能的-構造的なつながりの一端を解明
発表雑誌
論文タイトル:Structure of PCNA in complex with DNMT1 PIP box reveals the basis for the molecular mechanism of the interaction
著者:Jimenji T., Matsumura R., Kori S., *Arita K.
雑誌名:Biochemical and Biophysical Research Communications (2019), 516, pp.578-583DOI information: 10.1016/j.bbrc.2019.06.060
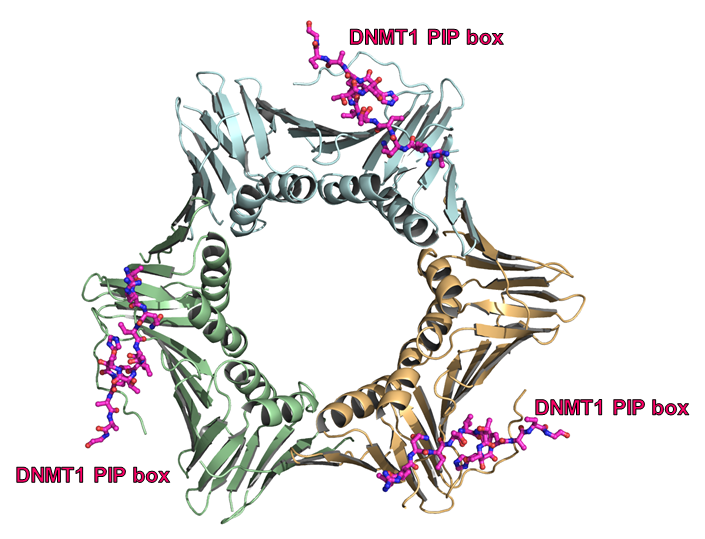 図1. PCNAとDNMT1のPIP boxペプチドの複合体の全体構造
図1. PCNAとDNMT1のPIP boxペプチドの複合体の全体構造
説明
図1は、PCNAを水色、緑、黄色のcartoon model, DNMT1のPIP boxペプチドをピンク色のスティックモデルで示す。
複製因子PCNAは3量体のリング状の構造をとり、DNA複製時にはリングの中央に複製中のDNAが通る。PCNAの各プロトマーに1分子のDNMT1のPIP boxペプチドが結合する。PCNAに結合する配列であるPIP (PCNA interacting protein) boxの保存された配列はQxxhxxaa (x;任意のアミノ酸, h;疎水性のアミノ酸, aa;芳香族アミノ酸)である。DNMT1のPIP boxの配列はQTTITSHFである。
複製因子PCNAは3量体のリング状の構造をとり、DNA複製時にはリングの中央に複製中のDNAが通る。PCNAの各プロトマーに1分子のDNMT1のPIP boxペプチドが結合する。PCNAに結合する配列であるPIP (PCNA interacting protein) boxの保存された配列はQxxhxxaa (x;任意のアミノ酸, h;疎水性のアミノ酸, aa;芳香族アミノ酸)である。DNMT1のPIP boxの配列はQTTITSHFである。
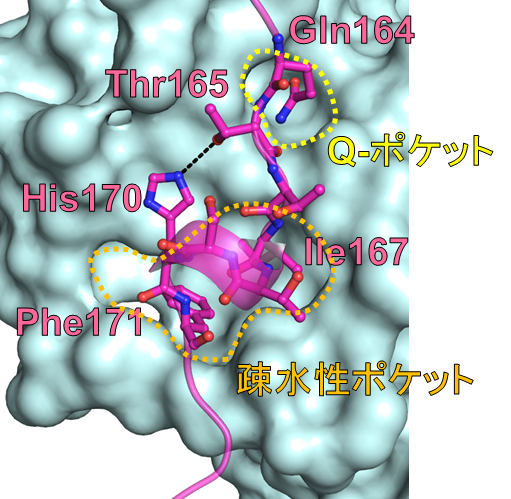 図2. DNMT1のPIP boxペプチドの認識機構の詳細
図2. DNMT1のPIP boxペプチドの認識機構の詳細
図2は、PCNAを水色の表面図、 DNMT1のPIP boxペプチドをピンク色のスティック図で示した。黒点線は水素結合を示す。
- DNMT1の保存されたグルタミン残基 (Gln164) の側鎖は、PCNAのQ-ポケット (黄色の点線) で認識される。DNMT1の保存された疎水性のイソロイシン167 (Ile167) とフェニルアラニン171 (Phe171) はPCNAの疎水性ポケット (オレンジ色の点線) で認識される。
- DNMT1のスレオニン165 (Thr165) とヒスチジン170 (His170) のアミノ酸の側鎖同士の水素結合が観測された。この水素結合はPCNAと相互作用する他のタンパク質では見られない。この新規の相互作用は、DNMT1 PIP boxペプチドの構造の安定化に寄与すると考えられる。
問い合わせ先
TEL: 045-508-7301, FAX: 045-508-7365
E-mail: aritak@yokohama-cu.ac.jp